Dans ce chapitre, nous allons aborder le sujet du tableau d’avancement et sa signification. La maîtrise de ce chapitre est essentielle, car dans presque tous les sujets de chimie (contrôles ou baccalauréat), vous devrez réaliser au moins un tableau d’avancement ! Pour bien comprendre ce chapitre, il est important de maîtriser les réactions chimiques (coefficients stœchiométriques, équilibrage des réactions, etc.). Si vous ne l’avez pas encore fait, je vous invite à bien étudier le chapitre sur les réactions chimiques.
Principe général
Prenons une équation assez générale (simple pour commencer) : supposons que nous ayons deux réactifs A et B, qui réagissent pour former deux produits C et D. Dans un premier temps, nous supposons que les coefficients stœchiométriques sont tous les deux égaux à 1, donc l’équation est : A + B → C + D. Les réactifs A et B ont chacun une certaine quantité de matière (n0 et n1) à l’instant initial (t = 0 s). Les quantités de matière initiales des réactifs sont notées n0 et n1, exprimées en moles.
En revanche, les produits C et D ne sont pas présents à l’instant initial, car ce sont les produits de la réaction (ils apparaîtront au fur et à mesure de la réaction).
Nous introduisons alors une variable x, appelée avancement (exprimée en moles), qui décrit l’évolution de la réaction. À l’instant initial, x = 0 mol car la réaction n’a pas encore commencé. Au fur et à mesure que la réaction se déroule, x augmente jusqu’à atteindre une valeur maximale, notée xmax.
- À retenir :
- L’avancement x est exprimé en moles.
- x = 0 mol à l’instant initial.
- x augmente au cours de la réaction jusqu’à atteindre une valeur maximale, notée xmax.
- x est donc toujours positif !
Pour récapituler tout cela, nous construisons un tableau appelé tableau d’avancement. Nous ajoutons les différentes lignes progressivement. La première ligne correspond à l’équation, mais nous ajoutons deux colonnes à gauche : une pour décrire l’état du système et l’autre pour donner la valeur de l’avancement.
Etat du système Avancement A + B → C + D Ensuite, nous ajoutons une ligne correspondant à l’état initial du système.
- Remarque : les valeurs du tableau d’avancement correspondent aux quantités de matière des espèces et sont donc toujours en moles, il n’est donc pas nécessaire de le préciser !
Etat du système Avancement A + B → C + D Etat initial (t = 0 s) x = 0 n0 n1 0 0 En effet, à l’instant initial, il y a n0 moles de A, n1 moles de B et 0 moles de C et de D.
Ensuite, avant de passer à l’état final, nous ajoutons une ligne pour décrire l’état intermédiaire du mélange réactionnel. Nous nous plaçons à un instant t quelconque et l’avancement est noté x en tant que variable. Les quantités de matière des réactifs diminuent, tandis que celles des produits augmentent. La quantité de matière de A est donc n0 – x, celle de B est n1 – x, celles de C et D sont 0 + x, donc x. Nous pouvons donc ajouter la ligne suivante :
Etat du système Avancement A + B → C + D Etat initial (t = 0 s) x = 0 n0 n1 0 0 Etat intermédiaire x n0 - x n1 - x x x Il ne reste plus qu’à ajouter une ligne pour l’état final du système. Comme nous l’avons dit, l’avancement est alors xmax. Il suffit donc de remplacer tous les x de la ligne “état intermédiaire” par xmax.
Etat du système Avancement A + B → C + D Etat initial (t = 0 s) x = 0 n0 n1 0 0 Etat intermédiaire x n0 - x n1 - x x x Etat final xmax n0 - xmax n1 - xmax xmax xmax Et voilà, c’est terminé ! Enfin, presque… vous pouvez bien sûr remplacer n0 et n1 par les valeurs données dans l’énoncé ou celles que vous avez calculées auparavant.
- Remarque : la colonne “Etat du système” est un peu redondante avec la colonne “Avancement”, donc avec le temps, vous pourrez ne mettre qu’une des deux. De même, la ligne “Etat intermédiaire” n’est parfois pas utile, donc vous pourrez vous en passer. Cependant, pour vous habituer, nous les mettrons systématiquement dans ce cours. Bien sûr, vous devrez vous adapter à ce que votre professeur vous dira en classe.
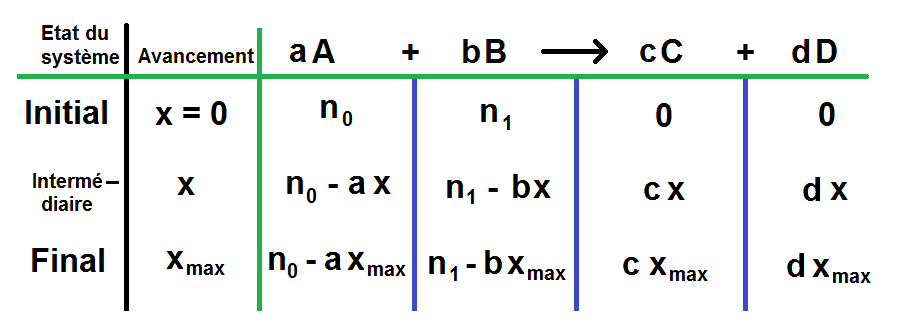
En réalité, c’est légèrement plus complexe que cela, comme nous l’avons indiqué précédemment. En effet, les coefficients stœchiométriques ne sont pas toujours égaux à 1, comme dans l’exemple précédent.
Prenons l’équation suivante pour illustrer cela : A + 3B → 4C + D. Le tableau sera exactement le même, mais les coefficients stœchiométriques apparaîtront devant x et xmax. Nous aurons donc :
Etat du système Avancement A + 3B → 4C + D Etat initial (t = 0 s) x = 0 n0 n1 0 0 Etat intermédiaire x n0 - x n1 - 3x 4x x Etat final xmax n0 - xmax n1 - 3xmax 4xmax xmax Comme vous pouvez le constater, ce n’est pas si compliqué, il suffit simplement de mettre le coefficient devant x et xmax dans la colonne correspondante. La règle est la même pour les réactifs et les produits.
- ATTENTION ! Les coefficients stœchiométriques se retrouvent uniquement devant x et xmax, PAS devant les quantités de matière initiales n0 et n1 !
Prenons un autre exemple pour être sûr que vous avez bien compris, avec l’équation suivante : 2A + 5B → C + 3D (amusez-vous à trouver tout seul le tableau d’avancement pour vous entraîner) :
Etat du système Avancement 2A + 5B → C + 3D Etat initial (t = 0 s) x = 0 n0 n1 0 0 Etat intermédiaire x n0 - 2x n1 - 5x x 3x Etat final xmax n0 - 2xmax n1 - 5xmax xmax 3xmax Normalement, vous devriez obtenir ceci.