Lorsqu’il s’agit de se conformer à la norme ISO 13485, la documentation est essentielle. Mais combien de documentation avez-vous vraiment besoin ? Et comment organiser votre documentation pour répondre aux exigences de la norme ? Dans cet article, nous allons examiner les exigences de documentation de l’ISO 13485 et vous donner des conseils pratiques pour vous aider à vous conformer.
Combien de documentation avez-vous besoin ?
La quantité de documentation requise dépend de la taille et de la complexité de votre organisation. Vous devez disposer de suffisamment de procédures pour couvrir chaque section de la norme qui s’applique à votre entreprise. La documentation est divisée en deux types : les documents et les enregistrements. Un formulaire est un type de document. Lorsque le formulaire est rempli, il devient un enregistrement. Le manuel qualité, la politique, les procédures ou les instructions de travail sont d’autres types de documents.
Les documents et les enregistrements spécifiques que vous devez contrôler sont énumérés dans le tableau ci-dessous. Les clauses suivantes de l’ISO 13485 requièrent des procédures documentées pour définir et contrôler les exigences et pratiques :
Documents requis par l’ISO 13485 :
- Rôles joués par l’organisation conformément aux exigences réglementaires applicables
- Procédures et enregistrements pour la validation de l’application des logiciels informatiques
- Manuel qualité
- Dossier de dispositif médical
- Procédure de maîtrise des documents
- Procédure de maîtrise des enregistrements
- Politique qualité
- Objectifs qualité
- Responsabilités et autorités
- Procédure et enregistrements pour l’examen de direction
- Procédure de formation
- Exigences pour l’infrastructure et les activités de maintenance
- Exigences pour l’environnement de travail
- Dispositions pour le contrôle des produits contaminés ou potentiellement contaminés
- Processus de gestion des risques dans la réalisation du produit
- Résultats de la planification de la réalisation du produit
- Enregistrements des résultats de l’examen des exigences du client et des mesures prises à cet égard
- Dispositions pour la communication avec les clients
- Procédure de conception et de développement
- Planification de la conception et du développement
- Résultats de la conception et du développement
- Enregistrements de l’examen de la conception et du développement
- Plans, résultats et conclusions de la validation de la conception
- Procédure de transfert des résultats de la conception et du développement à la fabrication
- Procédure et enregistrements pour le contrôle des modifications de la conception et du développement
- Dossier de conception et de développement
- Procédure d’achat
- Critères et enregistrements pour l’évaluation et la sélection des fournisseurs
- Enregistrement de la vérification du produit acheté
- Enregistrement de traçabilité pour chaque dispositif médical ou lot
- Exigences pour la propreté du produit
- Exigences pour l’installation du dispositif médical et critères d’acceptation de l’installation
- Enregistrements de l’installation du dispositif médical et de la vérification de l’installation
- Procédure et enregistrements pour l’entretien du dispositif médical
- Enregistrements du processus de stérilisation
- Procédure et enregistrements de validation du processus de production et de prestation de services
- Procédure et enregistrements de validation du processus de stérilisation et des systèmes de barrières stériles
- Procédure d’identification du produit
- Procédure de traçabilité
- Enregistrements de traçabilité et nom et adresse du destinataire de l’emballage d’expédition
- Rapport sur les modifications des biens du client
- Procédure de préservation de la conformité du produit
- Procédure de surveillance et de mesure
- Enregistrement d’étalonnage
- Procédure et enregistrements pour la validation de l’application des logiciels informatiques utilisés pour la surveillance et la mesure
- Procédure de rétroaction du client
- Procédure et enregistrements pour la gestion des réclamations
- Enregistrements des déclarations aux autorités réglementaires
- Procédure d’audit interne
- Enregistrements des audits et de leurs résultats
- Personne autorisant la libération du produit
- Procédure et enregistrement de maîtrise des produits non conformes
- Enregistrements des travaux de remise en état
- Procédure et enregistrements d’analyse des données
- Procédure et enregistrements d’action corrective
- Procédure et enregistrements d’action préventive
Outre les documents requis par votre juridiction individuelle, l’ISO vous demande de documenter des éléments tels que :
- Politique et objectifs qualité
- Manuel qualité
- Procédure de validation des logiciels informatiques
- Procédures et enregistrements qualité
- Dossier de dispositif médical
Comment organiser ma documentation ?
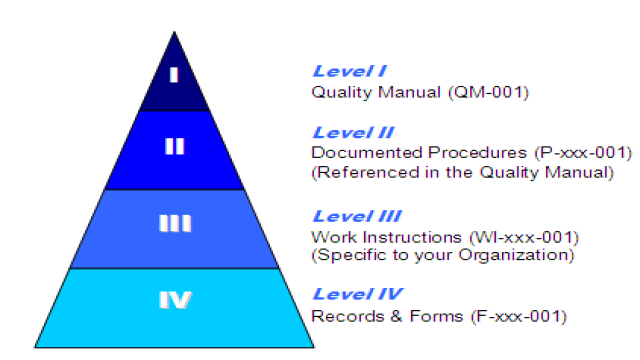
Si vous regardez cette pyramide, plus les éléments sont bas, plus ils sont spécifiques à votre entreprise. Les niveaux supérieurs (QM, Proc) sont dictés par la norme.
- Le Manuel qualité décrit le système de gestion de la qualité.
- Les procédures décrivent un processus (Achat).
- Les instructions de travail décrivent une activité au sein d’un processus (Création d’une commande d’achat).
- Les formulaires enregistrent les actions d’une activité ou d’un processus.
N’oubliez pas qu’un enregistrement est un formulaire ou un tableau rempli qui prouve que l’action a eu lieu.
Ai-je besoin de procédures et de diagrammes de flux ?
Non. Les procédures écrites sont plus informatives et beaucoup plus faciles à modifier que les flux. Parfois, il peut être fastidieux de modifier des organigrammes – il vaut souvent mieux les créer vous-même.
Vous devez avoir un diagramme de vos processus globaux, et nous vous recommandons d’utiliser un logiciel comme Lucidchart pour les créer.
Maintenant que vous connaissez les exigences de documentation de l’ISO 13485, vous êtes prêt à mettre en place votre système de gestion de la qualité. Assurez-vous de suivre ces exigences à la lettre pour garantir la conformité de votre entreprise.