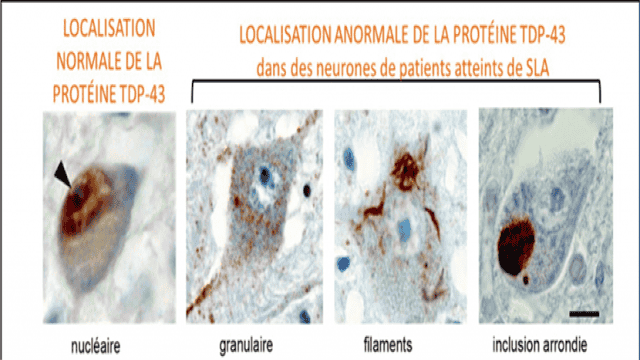
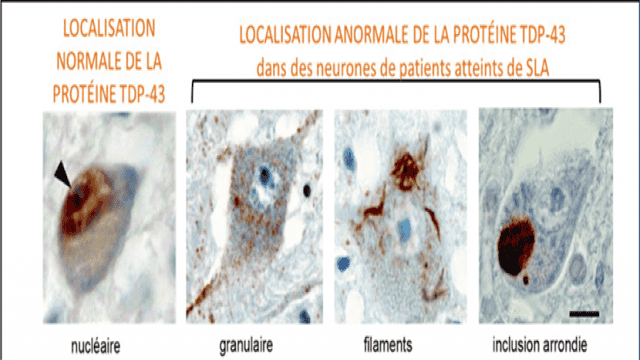
Découverte en 2011, la mutation du gène C9ORF72 est présente dans environ 40% des formes familiales de la sclérose latérale amyotrophique (SLA) et 30% des formes familiales de la démence frontotemporale (DFT). De plus, 70% des patients sont atteints des deux pathologies DFT/SLA. On a également identifié en 2006 des agrégats toxiques de la protéine TDP-43 dans ces maladies. Aujourd’hui, on sait que ces agrégats sont présents dans 95% des cas de SLA, toutes formes confondues (familiales et sporadiques), et 60% des cas de DFT. Cette découverte des agrégats communs aux deux pathologies a permis de donner une base moléculaire à ce continuum clinique observé depuis longtemps par les médecins. Cependant, le lien physiologique entre la mutation du gène C9ORF72 et les agrégats de TDP-43 n’est pas encore clairement identifié.
D’après Elisa Teyssou et al, Acta Neuropathologica 2013, 125 : 512-522.
Images générées par le Pr Danielle Seilhean, anatomopathologiste dans l’équipe de Séverine Boillée.
Une perturbation de l’autophagie ?
Une des raisons suspectées de la présence de ces agrégats toxiques est un défaut du recyclage des déchets à l’intérieur des cellules. Le gène de l’Ubiquiline 2 (UBQLN2) fait partie des gènes impliqués dans le développement de la SLA. Il est nécessaire à la dégradation des déchets dans les neurones. Des études menées par plusieurs équipes de l’Institut du Cerveau en collaboration avec l’Université de Limoges se sont penchées sur les mutations de l’Ubiquiline 2. Grâce à des études fonctionnelles, les chercheurs ont mis en évidence que l’une des voies de dégradation cellulaire, l’autophagie, était altérée chez les patients porteurs d’une mutation de l’Ubiquiline 2.
Plus d’informations : https://institutducerveau-icm.org/fr/actualite/sla-de-nouvelles-decouvertes/
Une inflammation chronique
On sait depuis longtemps que les agrégats protéiques dans le cerveau, tels que les plaques amyloïdes dans la maladie d’Alzheimer ou l’a-synucléine dans la maladie de Parkinson, sont sources d’inflammation. Cependant, dans le cas de la TDP-43, ce mécanisme reste à élucider.
Le rôle de la microglie, les cellules immunitaires résidentes du système nerveux, dans la maladie est aujourd’hui bien admis. Les motoneurones spinaux affectés dans la SLA sont entourés à la fois par des cellules microgliales dans la moelle épinière et par des macrophages périphériques dans le nerf qui contiennent la partie du motoneurone sortant de la colonne vertébrale pour connecter le muscle à la périphérie. Jusqu’à récemment, le rôle des macrophages était sujet à débat. En 2020, l’équipe de Séverine Boillée à l’Institut du Cerveau a montré pour la première fois un rôle important des macrophages périphériques dans la progression de la SLA. Comme les microglies, ces derniers génèrent un état inflammatoire chronique délétère pour les motoneurones. Les macrophages seraient donc plus faciles à cibler depuis la périphérie que les cellules microgliales dans le système nerveux central.
Plus d’informations : https://institutducerveau-icm.org/fr/actualite/sclerose-laterale-amyotrophique-sla-maladie-de-charcot/
A l’Institut du Cerveau – ICM
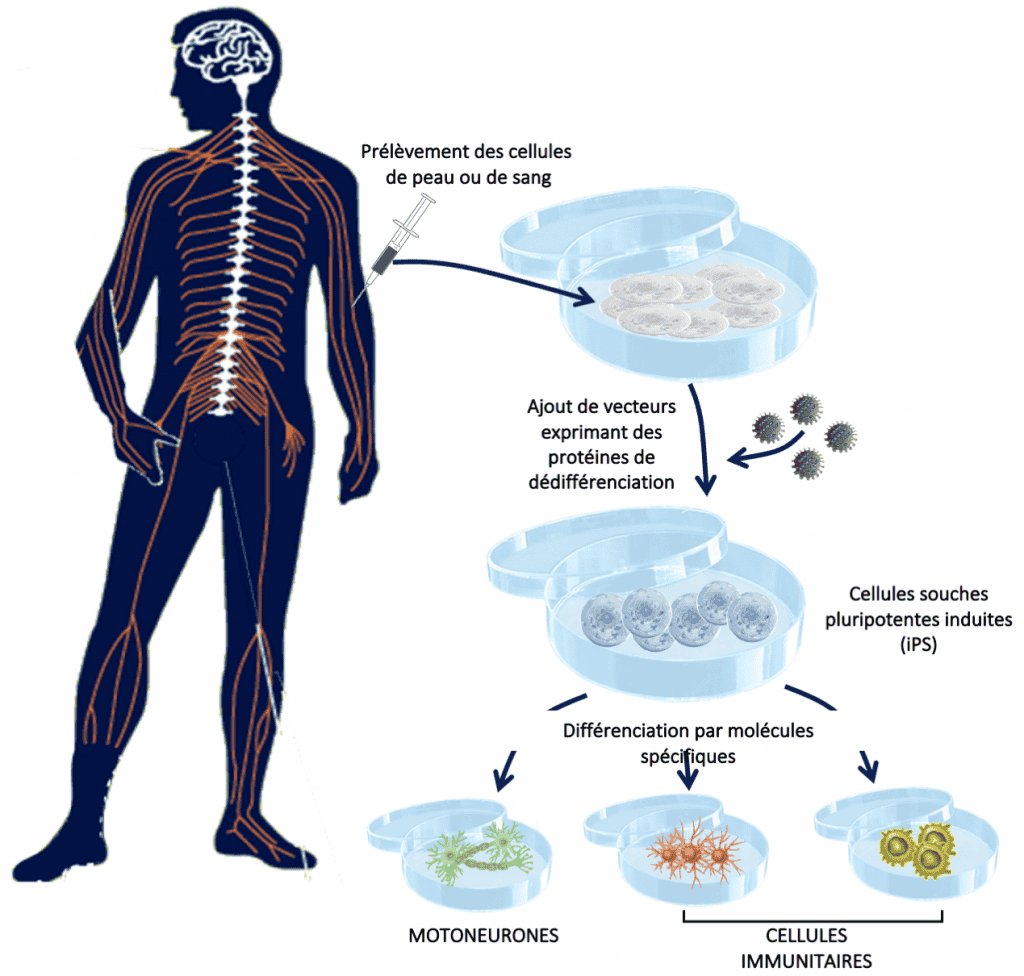
L’objectif de Delphine Bohl, dans l’équipe de Séverine Boillée, est de modéliser la maladie grâce aux cellules souches pluripotentes induites humaines (iPSC). Cette technologie permet de générer différentes cellules, y compris des motoneurones ou des cellules immunitaires, à partir de cellules de peau prélevées chez les patients. Les iPSC ont la capacité de se multiplier indéfiniment et de se différencier en n’importe quel type cellulaire de l’organisme, pourvu qu’elles soient exposées aux bons signaux. Ces nouveaux modèles cellulaires permettent pour la première fois d’étudier des neurones humains de patients. La première étape consiste à caractériser précisément les motoneurones obtenus à partir des cellules iPSC des patients, en commençant par les cas génétiques où la mutation à l’origine de la SLA est connue, puis en étudiant les cas sporadiques afin d’identifier d’éventuels mécanismes communs. La deuxième étape est de réunir les motoneurones et les cellules immunitaires dans un environnement contrôlé pour étudier leurs interactions. Ces modèles permettront également de tester l’efficacité de molécules thérapeutiques.
Protocole d’obtention de cellules souches pluripotentes induites (iPS) et leurs dérivés: