La séquençage de l’ARN à une cellule unique (scRNA-seq) et d’autres méthodes basées sur le séquençage de cellules uniques ou de noyaux uniques, telles que le profilage immunitaire ou le profilage de l’accessibilité de la chromatine, sont des approches puissantes qui permettent aux chercheurs d’explorer la dynamique de l’expression génique, la régulation génique, la spécificité antigénique, et bien plus encore, cellule par cellule. Cependant, pour tirer le meilleur parti de ces outils, il est nécessaire de savoir comment préparer correctement vos échantillons.
En fait, ce qui se passe en amont de vos expériences sur cellules uniques peut être tout aussi important que les expériences elles-mêmes. Une préparation minutieuse des échantillons qui permet d’obtenir une suspension de cellules ou de noyaux de haute qualité sera un facteur déterminant clé pour une expérience réussie.
C’est pourquoi nous voulons faire tout notre possible pour vous fournir les astuces et les connaissances dont vous avez besoin pour maîtriser la préparation des échantillons de cellules uniques. Cela inclut les bases – cellules contre noyaux, le nombre de cellules à utiliser, comment maximiser la viabilité cellulaire, la logistique des échantillons, et bien plus encore.
La conception expérimentale influence les choix de préparation des échantillons
Dois-je utiliser des cellules uniques ou des noyaux pour mon expérience ?
Votre conception expérimentale globale, et en particulier les analytes que vous souhaitez mesurer, détermineront si vous devez utiliser des cellules uniques ou des noyaux. Le scRNA-seq fonctionne avec les deux types, et dans la plupart des cas, vous obtiendrez des résultats très similaires. Cependant, si vous souhaitez mesurer les séquences de récepteurs B ou T (BCR/TCR) ou d’autres protéines de surface cellulaire, vous devrez maintenir des cellules entières intactes pour vos expériences. Si vous souhaitez mesurer l’accessibilité de la chromatine, vous devrez utiliser des noyaux.
De plus, le tissu ou le liquide biologique avec lequel vous travaillez peut influencer votre décision entre les cellules et les noyaux. Par exemple, les cellules hépatocytaires et les neurones sont, dans certains cas, trop grandes pour passer à travers le canal microfluidique de l’instrument Chromium, qui peut accueillir des cellules jusqu’à 30 microns de diamètre. Dans ces cas, vous voudrez isoler les noyaux de vos échantillons. Certains types de cellules peuvent également avoir une forme difficile (comme les cardiomyocytes ou les cellules de levure), ce qui rendrait l’isolement des noyaux plus approprié. Certains tissus complexes sont très difficiles à dissocier en une suspension de cellules uniques, donc, là encore, l’isolement des noyaux peut être la meilleure option pour ces tissus.
Combien de cellules sont nécessaires pour une expérience sur cellules uniques ?
Il n’y a pas de réponse simple, car cela dépend de la complexité de votre échantillon et de vos questions expérimentales. Plus votre échantillon est complexe – c’est-à-dire s’il est très hétérogène ou s’il contient des cellules fragiles qui sont généralement plus difficiles à maintenir lors de la préparation des échantillons – plus vous aurez besoin de cellules. De plus, si vous vous intéressez aux populations cellulaires rares, il est probable que vous deviez commencer avec un plus grand nombre de cellules pour pouvoir identifier ces types de cellules présentes en faible proportion.
En revanche, si votre échantillon est assez homogène et robuste, et que la plupart des cellules sont susceptibles de réagir de manière similaire tout au long de votre expérience (y compris lors de tout traitement et des étapes de préparation des échantillons éventuels), vous pouvez commencer avec moins de cellules.
Il est important de se souvenir que nos tests sur cellules uniques ont un taux de capture cellulaire allant jusqu’à 65 %, ce qui signifie que vous verrez probablement une récupération de 65 % des cellules chargées sur une puce. Vous devriez prévoir d’exécuter le nombre approprié de cellules en gardant ce taux de capture à l’esprit, afin de pouvoir atteindre le nombre final de cellules ciblées. Les exigences de séquençage doivent également être prises en compte à ce stade de votre conception expérimentale, car plus vous utilisez de cellules, plus les coûts de séquençage seront élevés.
Comment garantir un échantillon de cellules uniques de la plus haute qualité
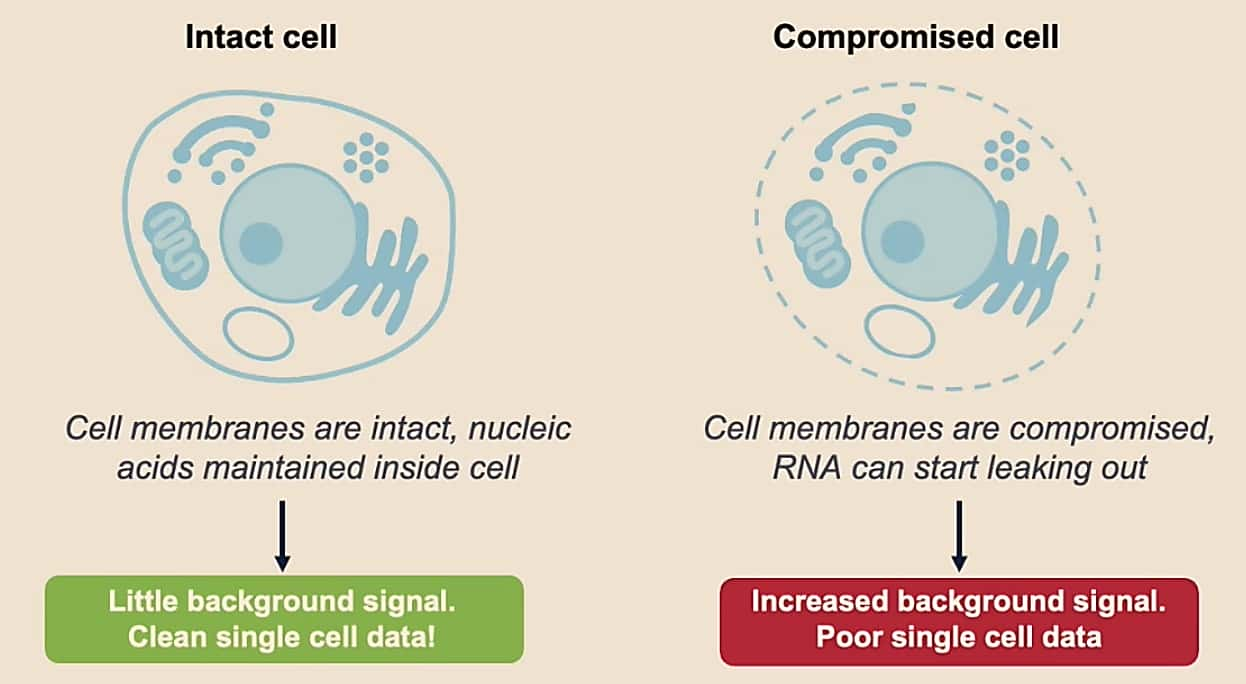
Pourquoi la qualité de l’échantillon est-elle importante ?
Vous voulez vous assurer de capturer des informations provenant de cellules individuelles. Lorsqu’une cellule n’est pas intacte, elle commencera à fuir de l’ARN, ce qui peut augmenter le signal de fond. Ainsi, un échantillon de mauvaise qualité diminue notre confiance que les transcriptions d’ARN proviennent d’une cellule en particulier et que nous capturons des informations véridiques sur cette cellule.
Qu’est-ce qui fait un échantillon de cellules uniques de bonne qualité ?
Il existe trois critères de base à garder à l’esprit lors de la préparation des échantillons. Un échantillon de bonne qualité doit être :
- Propre : Les suspensions de cellules uniques doivent être exemptes de débris, d’agrégats cellulaires et de tout autre contaminant (comme l’ARN de fond, l’ADN ou l’EDTA). Cela nécessite de laver les échantillons par des étapes de centrifugation, de filtrer les échantillons pour exclure les débris ou les particules plus grosses, et d’enrichir les cellules par tri ou en utilisant des kits de suppression des cellules mortes.
- Sain : Vous voulez que vos cellules soient vivantes ! Nous recommandons une viabilité d’au moins 90 % pour obtenir des données de cellules uniques de haute qualité. Et pendant la préparation des puces, les cellules doivent être conservées dans une solution PBS + 0,04 % d’albumine de sérum bovin (BSA) sur glace. Ce tampon n’est pas nécessairement très riche en nutriments, donc si vous pensez que votre échantillon en a besoin, vous pouvez utiliser l’un des milieux de culture cellulaire alternatifs que nous avons validés (mentionnés dans le guide de préparation des cellules ci-dessous) pour maintenir la viabilité des cellules.
- Intact : Il est très important de conserver l’intégrité des membranes cellulaires, ce qui nécessite de traiter les cellules avec beaucoup de douceur. Nous recommandons d’utiliser des embouts de pipette à large orifice pour resuspendre lentement et doucement les cellules.
Que faire si mon échantillon ne respecte pas les critères de qualité ?
Vous pourrez peut-être quand même travailler avec cet échantillon, mais il est important de réfléchir à la façon d’optimiser l’échantillon avant votre expérience. En d’autres termes, si vous décongelez ou collectez un échantillon qui ne répond pas aux normes de qualité, vous devez avoir un plan pour l’améliorer. Il existe de nombreuses options à explorer dans ce cas, notamment l’utilisation de kits de suppression des cellules mortes, l’enrichissement des cellules vivantes et l’enrichissement ou l’épuisement de certains types de cellules spécifiques, entre autres méthodes.
Pourquoi le comptage des cellules est-il important avant de charger les cellules sur la puce Chromium ?
Un comptage précis des cellules est non seulement essentiel pour atteindre le nombre cible de cellules pour vos objectifs expérimentaux, mais il peut également être considéré comme une vérification finale de la qualité de l’échantillon. Que vous utilisiez un hématocytomètre manuel ou un compteur de cellules automatisé, il est important d’avoir un processus cohérent et d’inclure des marqueurs de discrimination des cellules vivantes/mortes. La coloration au bleu trypan peut être utilisée pour distinguer les cellules vivantes et mortes lorsque les échantillons ne contiennent pas beaucoup de débris. Cependant, il est préférable d’utiliser un colorant fluorescent pour vous assurer de ne pas tacher les débris et de ne pas les compter comme des cellules, en particulier lors du travail avec des compteurs automatisés.
Quels sont les critères à prendre en compte pour la qualité des échantillons de noyaux ?
L’isolement des noyaux nécessite une optimisation du temps dans le tampon de lyse. La lyse doit être aussi complète que possible, avec idéalement moins de 5 % de cellules vivantes restantes dans la suspension après la lyse. (Cette recommandation est bien sûr contraire aux objectifs de dissociation des cellules uniques, où nous essayons de maintenir autant de cellules vivantes que possible !) Bien que l’isolement des noyaux détruise essentiellement les cellules entières, vous voudrez toujours commencer la lyse avec un échantillon de cellules vivantes et en bonne santé.
De plus, vous voudrez vous assurer que vos noyaux isolés sont arrondis et ont une membrane nucléaire intacte. Si la lyse se poursuit trop longtemps, le noyau peut “se boursoufler”, c’est-à-dire qu’il commencera à avoir une surface moussante, une forme irrégulière et peut former des grumeaux avec d’autres noyaux.
Le comptage sera différent lors de l’utilisation de noyaux. Tous les noyaux seront colorés comme des cellules mortes. Ils sont également très petits par rapport aux cellules entières et seront en suspension avec d’autres débris. Par conséquent, le comptage avec seulement du bleu trypan peut être inexact. Dans ces conditions, nous vous recommandons d’utiliser une coloration fluorescente, comme l’éthidium homodimère-1, pour un comptage précis.
L’obtention d’une suspension de noyaux de bonne qualité peut être particulièrement délicat avec les exigences d’optimisation de la lyse. Notre kit d’isolement des noyaux peut éliminer les conjectures de ce processus, car il a été validé sur plusieurs échantillons humains et de souris. Découvrez comment il peut faciliter la préparation des échantillons de noyaux uniques de manière facile et reproductible.
La logistique des échantillons est importante pour la préparation des cellules uniques
La logistique de la collecte, de la conservation et de la manipulation de vos échantillons a un impact énorme sur la qualité des échantillons et, finalement, sur les données finales. Dans un scénario idéal, vous pouvez traiter votre échantillon immédiatement après la collecte, mais cela n’est souvent pas possible. Il est donc extrêmement important d’avoir un plan de conservation des échantillons pour garantir le succès.
Quelles sont les bonnes pratiques pour préserver les cultures cellulaires et les cellules en suspension ?
Normalement, les cellules en culture se portent bien lorsqu’elles sont congelées dans leur milieu avec du DMSO supplémentaire en tant que cryoprotecteur. Elles doivent ensuite être congelées lentement à -80°C et transférées à l’azote liquide pour un stockage à long terme.
Comment dois-je conserver les tissus frais pour la préparation d’échantillons de cellules uniques ?
Dans le cas où le tissu frais peut être traité dans un délai assez court après la dissection ou la biopsie, la meilleure pratique est de conserver brièvement le tissu sur de la glace, puis de le dissocier en une suspension de cellules uniques. Les cellules dissociées peuvent ensuite être congelées dans un milieu de culture cellulaire avec du DMSO ou une solution de cryopréservation spécialisée pour maintenir la viabilité cellulaire jusqu’à ce que vous soyez prêt à exécuter l’analyse de cellules uniques.
Lorsque vous ne pouvez pas traiter immédiatement le tissu frais pour la dissociation des cellules uniques, il y a d’autres considérations avant de choisir une méthode de préservation des échantillons. Deux considérations sont le laps de temps dont vous disposez avant de pouvoir dissocier le tissu et si vous souhaitez travailler avec des noyaux ou des cellules. Si l’intervalle entre la collecte de l’échantillon et la dissociation est inférieur à 72 heures, il peut être possible de conserver l’échantillon dans une solution de stockage de tissus à 4°C. Cela permet également de travailler avec des cellules, bien que des études pilotes soient recommandées pour vous assurer d’obtenir des cellules vivantes à partir de cette méthode de stockage à court terme.
Si vous devez attendre plus de 72 heures, vous pouvez envisager la congélation rapide du tissu entier à -196°C. Cependant, cette méthode de traitement ne permet que l’isolement des noyaux lors des étapes ultérieures de préparation des échantillons. Alternativement, si vous devez attendre plus de 72 heures, vous pouvez envisager de stocker le tissu à -80°C dans un milieu de cryopréservation, dans le but de conserver les cellules entières intactes et de préserver les protéines de surface cellulaire. Dans les deux cas, des études pilotes sont recommandées, car ces méthodes de conservation n’ont pas été validées en interne, et il est essentiel de tester leur compatibilité avec le tissu d’intérêt.
Il existe d’autres méthodes de préservation des échantillons, y compris la fixation, que nous ne couvrirons pas dans cet article. Restez à l’écoute pour la prochaine partie de cette série sur la préparation des échantillons de cellules uniques, où nous fournirons un aperçu des options de préparation des échantillons disponibles avec Chromium Single Cell Gene Expression Flex.
Envie d’en savoir plus sur nos offres de produits pour les cellules uniques ? Voici quelques façons de le faire !
Trouvez le bon test sur cellules uniques pour vos objectifs expérimentaux spécifiques et les échantillons disponibles avec le Sélecteur de test sur cellules uniques Chromium, un outil interactif qui vous guide pas à pas à travers les points de décision clés. Commencez ici.
Pour tout savoir sur le portefeuille complet de tests sur cellules uniques, ainsi que sur les spécifications des produits et les applications possibles, téléchargez notre Guide de l’acheteur sur les cellules uniques. Téléchargez ici.