Depuis plusieurs années, l’IRM (imagerie par résonance magnétique) est devenue un outil de détection du cancer de la prostate extrêmement performant. Grâce à des images plus précises, l’IRM de diffusion permet de localiser les foyers tumoraux avec fiabilité. Ainsi, cet examen permet de guider la biopsie d’une lésion suspecte, en appliquant le principe général de l’oncologie : localiser la cible, puis guider le prélèvement par imagerie.
Les progrès de l’IRM
La clinique de l’Alma à Paris dispose d’une IRM à 1,5 Tesla de très haute qualité. Cette technologie de pointe permet d’obtenir des images de haute résolution, se rapprochant de celles des aimants de 3 Tesla. De plus, l’utilisation de l’IRM de diffusion permet d’éviter l’utilisation d’une antenne endorectale, qui peut être inconfortable pour les patients.
Un score IRM pour classer la présomption de malignité
Grâce aux avancées de l’IRM, il est désormais possible d’établir un score diagnostique, appelé score PI-RADS, pour déterminer la présomption de cancer. Les scores 1 et 2 correspondent à l’absence d’anomalie focale, tandis que les scores 3 à 5 indiquent la présence d’anomalies focales détectées par l’IRM de diffusion. Un score de 5 correspond à une présomption de cancer de 90%.
Les avantages de l’IRM pour la biopsie échoguidée
L’utilisation des données de l’IRM lors de la biopsie échoguidée améliore considérablement la performance du guidage échographique. Environ 80% des lésions détectées par l’IRM sont visibles à l’échographie par un opérateur entraîné. Dans les cas où la lésion n’est pas visible, un logiciel permet de superposer les images IRM et échographiques pour guider la biopsie. Cette technique permet de limiter le nombre de prélèvements à trois et de détecter les cancers agressifs tout en évitant de détecter les micro-cancers indolents.
La biopsie sous guidage IRM temps réel avec assistance robotique
Dans les cas plus complexes où la lésion est profonde ou de petite taille, il est possible de guider la biopsie directement sous IRM en utilisant un robot. Cette technique, qui utilise le même moyen d’imagerie pour sélectionner la lésion et guider l’aiguille, permet d’éviter les erreurs de recalage inhérentes à la fusion d’images.
L’IRM avant biopsie : le filtre pour détecter les tumeurs agressives
Grâce à sa valeur prédictive élevée, l’IRM peut être utilisée pour sélectionner les patients pour une biopsie en cas de taux de PSA élevé. En fonction du score PI-RADS, il est possible de recommander une biopsie immédiate ou de différer le prélèvement en mettant en place une surveillance régulière du PSA.
L’IRM de la prostate est donc un examen essentiel entre le dosage du PSA et la biopsie. Grâce à ses avancées technologiques, elle permet une détection plus précise des tumeurs et une meilleure guidance des biopsies. Ainsi, elle contribue à améliorer le diagnostic et la prise en charge des patients atteints de cancer de la prostate.
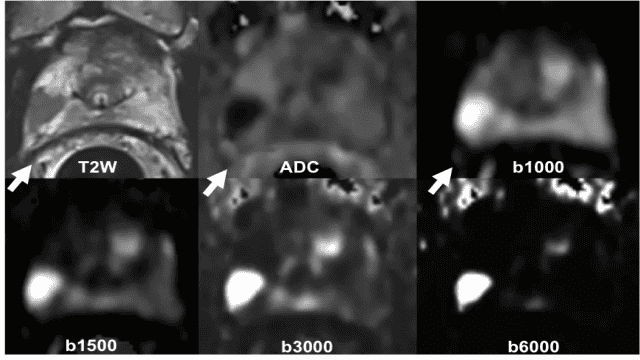
Figure 1 – IRM de diffusion – La tumeur (score PIRADS 4) est en hyposignal T2 (flèche). Sa visibilité sur l’IRM de diffusion augmente quand on augmente la valeur du gradient de diffusion (valeur de b), alors que le signal de la prostate bénigne s’éteint progressivement. Le coefficient de diffusion (ADC) est bas. Tumeur de score de Gleason 3+4 à la biopsie ciblée.
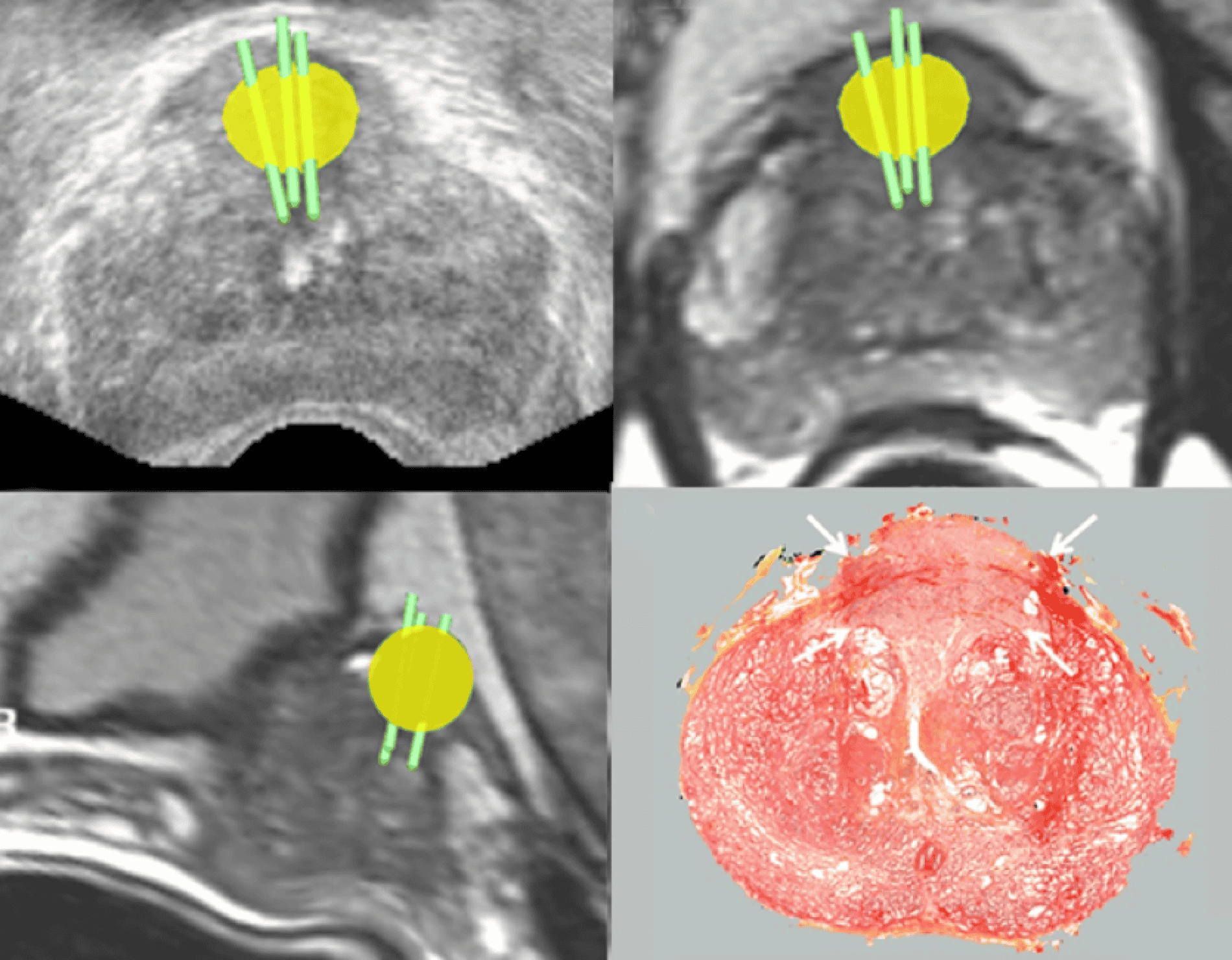
Figure 2 – Biopsie avec fusion d’images – La lésion suspecte (flèche), non visible à l’échographie, a été propagée sur l’échographie (cercle jaune, dessiné sur l’IRM). Les biopsies ont été guidées par échographie dans la cible. Tumeur antérieure, score de Gleason 4+3 sur les biopsies et sur la pièce de prostatectomie radicale (petites flèches blanches).
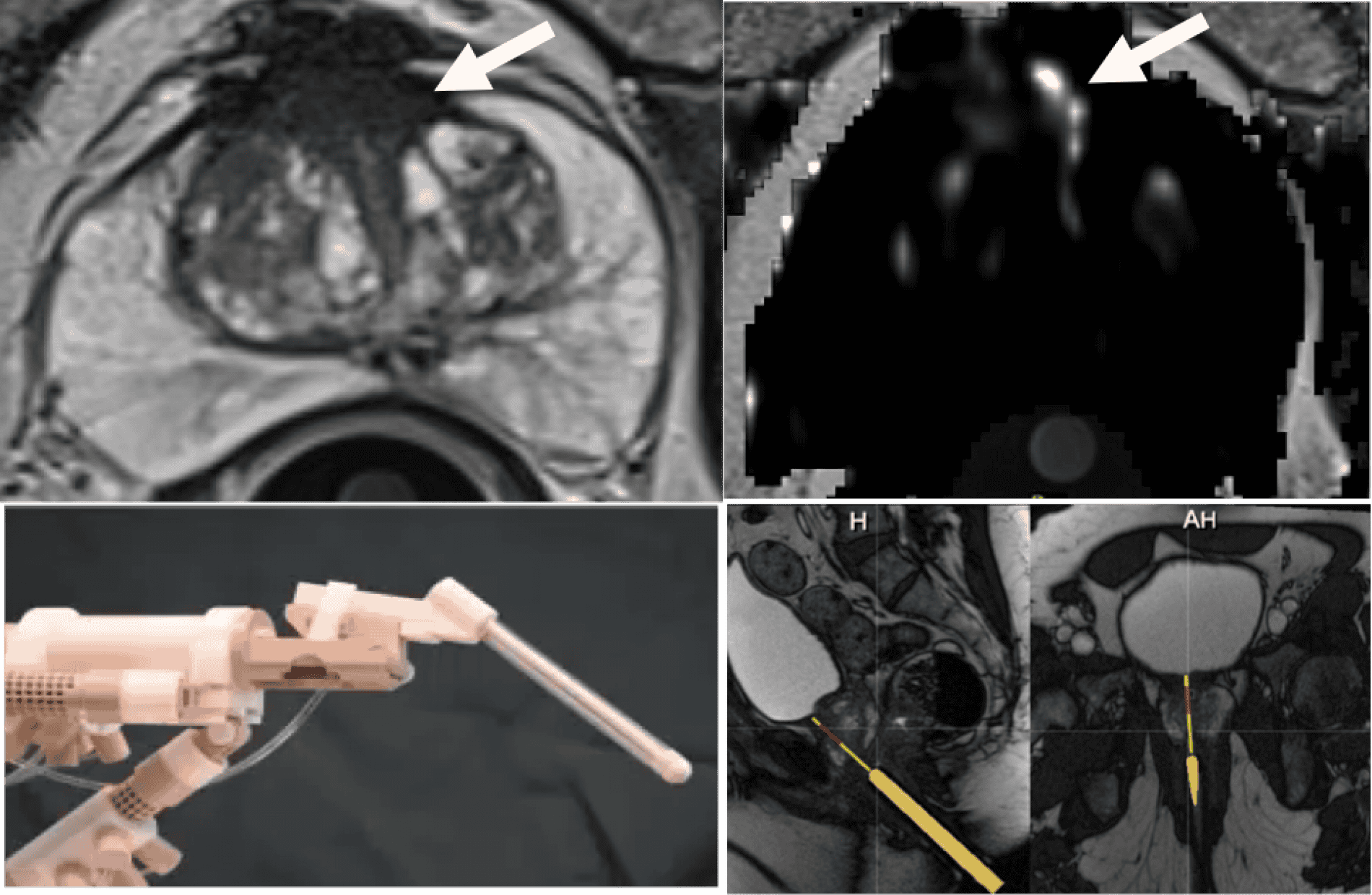
Figure 3 – Biopsie guidée par IRM avec assistance robotique – Cancer antérieur (flèche) manqué par des biopsies avec fusion d’images. Le robot, placé entre les jambes du patient pendant la biopsie, aligne le trajet du guide et de la cible. Le prélèvement est fait par le médecin : cancer score de Gleason 3+4 sur les deux prélèvements.
Références:
- Jambor I, Bostrom PJ, Taimen P, et al. Novel biparametric MRI and targeted biopsy improves risk stratification in men with a clinical suspicion of prostate cancer (IMPROD Trial). J Magn Reson Imaging. 2017.
- Weinreb JC, Barentsz JO, Choyke PL, et al. PI-RADS Prostate Imaging – Reporting and Data System: 2015, Version 2. Eur Urol. 2016;69(1):16-40.
- Ukimura O, Marien A, Palmer S, et al. Trans-rectal ultrasound visibility of prostate lesions identified by magnetic resonance imaging increases accuracy of image-fusion targeted biopsies. World J Urol. 2015.
- Ukimura O, Desai MM, Palmer S, et al. 3-Dimensional elastic registration system of prostate biopsy location by real-time 3-dimensional transrectal ultrasound guidance with magnetic resonance/transrectal ultrasound image fusion. The Journal of urology. 2012;187(3):1080-6.
- Cornud F, Brolis L, Delongchamps NB, et al. TRUS-MRI image registration: a paradigm shift in the diagnosis of significant prostate cancer. Abdominal imaging. 2013.
- Bomers JG, Bosboom DG, Tigelaar GH, et al. Feasibility of a 2nd generation MR-compatible manipulator for transrectal prostate biopsy guidance. Eur Radiol. 2016.
- Ahmed HU, El-Shater Bosaily A, Brown LC, et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet. 2017;389(10071):815-22.